TEMA:Modelos atómicos y modelo actual del átomo
1. El modelo atómico de los griegos
2.Modelo atómico de dalton
3.Descubrimiento del electrón y cual fue su experimento
4.Modelo de tompson.
5.El descumbrimento del proton y su núcleo
6.Modelo atómico de rutherfor.
7.Modelo de bonhr.
8.El modelo actual del átomo
solución
1. Modelo atómico de los griegos
Que es un átomo?
Es la unidad mas pequeña posible de un elemento químico
Historia
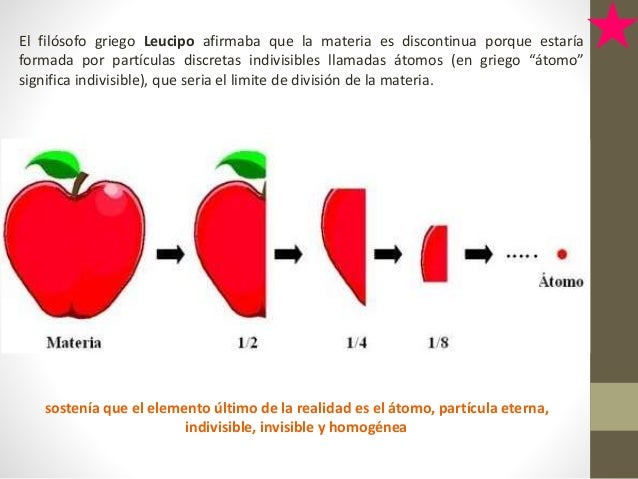
En el siglo V a. C., Leucipo sostenía que había un sólo tipo de materia y pensaba que si dividíamos la materia en partes cada vez más pequeñas, obtendríamos un trozo que no se podría cortar más. Demócrito llamó a estos trozos átomos (sin división). La filosofía atomista de Leucipo y Demócrito podía resumirse en:
1. Los átomos son eternos, indivisibles, homogéneos e invisibles.
2. Los átomos se diferencian en su forma y tamaño.
3. Las propiedades de la materia varían según el agrupamiento de los átomos.
2. Modelo atómico de Dalton
El modelo atómico de dalton explicaba porque las sustancias se combinaban químicamente entre si solo ciertas proporciones.
Ademas el modelo aclaraba que aun existiendo una variedad de sustancias,estas podían ser explicadas en términos de una cantidad mas bien pequeña de constituyentes elementales o elementos.
El trabajo de jhon dalton marco e inicio de la era moderna de la química a concebir en el 1808 ideas diferentes a las asumidas por los filósofos griegos.
Dalton propone al átomo como una masa propia de cada elemento combinable con otras masas propias a cada elemento,que podían ser combinados con otros,bajo las leyes de las proporciones definidas y múltiples;sin embargo su teoría no explico la afinidad de un elemento por otro,ni la presencia de partículas subatomicas,por lo contrario siempre considero al átomo como una masa compacta e indivisible.
De este modo establece que les elementos están formados por partículas mu pequeñas denominadas átomos y que los átomos de un mismo elemento poseen igual propiedad de tamaño y masa;no obstante según dalton los átomos de un elemento son distintos a los demás elementos.
3. Descubrimiento del electrón
Los científicos utilizaban la electricidad mucho antes de comprender cómo funcionaba realmente. Fue J.J. Thomson quien decidió investigar al respecto en el año 1897. Utilizó rayos catódicos para realizar los experimentos en campos eléctricos y magnéticos. Allí se dio cuenta que los rayos se componen de pequeñas partículas más pequeñas que los átomos, que él llamó “corpúsculos”, y que según él, carecían de interés para cualquier persona relacionada con la física.
¿Cómo se dio cuenta de ello? Cuando una descarga eléctrica se manda en un tubo de vacío, se ven un resplandor verde fosforescente. Entonces, Thomson decidió meter dentro una cruz de mica, apreciando que cuando circulaba la electricidad por el tubo, se producía una sombra perfecta en forma de cruz, lo que significa que algo viajaba en línea recta y se veía detenido por la mica.
4.Modelo de tompson
J.J Tompson demostró la existencia de partículas subatomicas en los átomos y que tales partículas son de carga negativa (Electrones) cuya relación carga- masa de :
1.76*108 coulomb/g.
El átomo como no tiene carga,de modo que tompson considero que los electrones estaban distribuidos uniformemente en una nube esférica con carga positiva.el numero de cargas negativas era el adecuado para neutralizar las cargas positivas.
El modelo atómico de tompson postulaba que si el átomo perdía un electrón la estructura quedaría cargada positivamente;y si por lo contrario, ganaba la carga final seria negativa,de esta manera desmostara las formas de iones;aunque la existencia de otras radiaciones no poseían respuesta bajo esta teoría.
5 Descubrimiento del proton y núcleo
Si consideramos a thompson como el descubrimiento del electrón por haber medido su relación de carga\de masa debemos debemos reconocer que el descubridor del proton fue el físico alemán wilhelm wein puesto que en 1898 midió la relación entre la carga y la masa del proton el experimento de rutherfor en 1918 había establecido definitivamente que el proton era un componente del núcleo bombardeando nitrógeno con partículas alfa rutherfor observo que se prducian protones y oxigeno con este experimento rutherfor desprendió por primera vez protones de su núcleo y desmostro que son unidades fundamentales de la estructura del núcleo atómico.Este experimento comprobó ademas la propocision de william prount enunciada en 1815 de que el hidrógeno es el elemento del cual se origina todos los demás ademas,fue la primera trasmutación nuclear obtenida artificialmente este hecho se recordara siempre como uno de los grandes procesos realizados por el hombre en la búsqueda de nuevos conocimientos.
Núcleo: Los experimentos llevado acabo en 1911 bajo la dirección de Ernest Rutherfor modificaron las ideas que existen sobre la naturaleza del átomo rutherfor y sus colaboradores bombardearon una fina lamina de pantalla fluorescente,en que medida eran dispersadas las partículas,la mayoría de ella atravesaban la lamina metálica sin cambiar de dirección, sin embargo unas pocas eran reflejadas hacia atrás con ángulos pequeños este era un resultado completamente inesperado incompatible con el modelo atómico macizo existente.mediante un análisis matemático de las fuerzas involucradas rutherfor demostró que la dispersión era causada por un pequeño núcleo cargado positivamente situado en el centro del átomo del oro de esta forma dedujo que la mayor parte de átomo era espacio vació lo que explicaba que la mayoría que las partículas que bombardeaban la lamina de oro pasaran atraves de ellas sin desviarse.
6. Modelo atómico de Rutherfor
El modelo atómico de rutherfor 1911 postulaba que el átomo esta formado por dos regiones una corteza y un núcleo en la corteza del átomo se encuentran los electrones girando a gran velocidad alrededor de núcleo,el núcleo es una región pequeña que se encuentra en e centro del átomo que posee la carga positiva ademas el núcleo posee la practica totalidad de la masa del átomo. Ernest rutherfor obtuvo la evidencia para este modelo a partir de un experimento en el que bombardeo con partículas alfa una fina lamina de oro según el comportamiento que experimentaban estos rayos y su trayectoria al incidir sobre la lamina de oro obtuvo las siguientes conclusiones.
Si consideramos a thompson como el descubrimiento del electrón por haber medido su relación de carga\de masa debemos debemos reconocer que el descubridor del proton fue el físico alemán wilhelm wein puesto que en 1898 midió la relación entre la carga y la masa del proton el experimento de rutherfor en 1918 había establecido definitivamente que el proton era un componente del núcleo bombardeando nitrógeno con partículas alfa rutherfor observo que se prducian protones y oxigeno con este experimento rutherfor desprendió por primera vez protones de su núcleo y desmostro que son unidades fundamentales de la estructura del núcleo atómico.Este experimento comprobó ademas la propocision de william prount enunciada en 1815 de que el hidrógeno es el elemento del cual se origina todos los demás ademas,fue la primera trasmutación nuclear obtenida artificialmente este hecho se recordara siempre como uno de los grandes procesos realizados por el hombre en la búsqueda de nuevos conocimientos.
Núcleo: Los experimentos llevado acabo en 1911 bajo la dirección de Ernest Rutherfor modificaron las ideas que existen sobre la naturaleza del átomo rutherfor y sus colaboradores bombardearon una fina lamina de pantalla fluorescente,en que medida eran dispersadas las partículas,la mayoría de ella atravesaban la lamina metálica sin cambiar de dirección, sin embargo unas pocas eran reflejadas hacia atrás con ángulos pequeños este era un resultado completamente inesperado incompatible con el modelo atómico macizo existente.mediante un análisis matemático de las fuerzas involucradas rutherfor demostró que la dispersión era causada por un pequeño núcleo cargado positivamente situado en el centro del átomo del oro de esta forma dedujo que la mayor parte de átomo era espacio vació lo que explicaba que la mayoría que las partículas que bombardeaban la lamina de oro pasaran atraves de ellas sin desviarse.
6. Modelo atómico de Rutherfor
El modelo atómico de rutherfor 1911 postulaba que el átomo esta formado por dos regiones una corteza y un núcleo en la corteza del átomo se encuentran los electrones girando a gran velocidad alrededor de núcleo,el núcleo es una región pequeña que se encuentra en e centro del átomo que posee la carga positiva ademas el núcleo posee la practica totalidad de la masa del átomo. Ernest rutherfor obtuvo la evidencia para este modelo a partir de un experimento en el que bombardeo con partículas alfa una fina lamina de oro según el comportamiento que experimentaban estos rayos y su trayectoria al incidir sobre la lamina de oro obtuvo las siguientes conclusiones.
- La mayor parte de los rayos atravesaban la lámina lo que le llevó a concluir que la mayor parte del átomo está hueco
- Solo una pequeña parte de las partículas sufría desviaciones, por lo que el núcleo debía ser pequeño, del orden de unas 10.000 veces menor que el radio atómico.
7.Modelo Atómico de Bonhr
Este modelo en 1913 postula que los electrones describen órbitas circulares estables alrededor del núcleo del átomo sin radiar energía,los electrones solo se pueden encontrar en ciertas órbitas(no todas las órbitas están permitidas),la distancia de la órbita al núcleo se determina según el numero cuántico n (n=1,n=2, n=3..)
el radio de la órbita (en Angstroms) r = 0,529 · n.2
los electrones solo emiten o absorben energía en los saltos entre órbitas .en dichos saltos se emiten o absorben un foton cuya energía es la diferencia de energía entre ambos niveles determinada por la formula.
- Ea - Eb = h · v = h · (RM · [1/nb2 - 1/na2]
El Modelo Atómico de Bohr explica las insuficiencias del Modelo Atómico de Rutherford sobre la estabilidad de las órbitas del electrón y la existencia de espectros de emisión característicos. El modelo de Bohr incorpora también la teoría del efecto fotoeléctrico de Einstein.
8.Modelo atómico actual.
El modelo atómico actual fue desarrollado durante la década de 1920 por Schrödinger y Heisenberg .entre otros investigadores .es un modelo de gran complejidad matemática este modelo es llamado"modelo orbital" o "cuántico-ondulatorio"se basa en:
1.la dualidad onda-corpúsculo .luis de broglie 1924 postula que el electrón se comporta como partícula o corpúsculo.
2.el principio de la incertidumbre de Hesenberg 1927 establece que "es imposible determinar simultáneamente y con exactitud,la posición y velocidad del electrón".
3.la naturaleza ondulatoria del electrón permite que este sea descrito por una ecuación de ondas Schrödinger. 1926 formulo una ecuación (ecuación de ondas Schrödinger)que describe el comportamiento y la energía de las partículas subatomicas.
4.aunque la mecánica cuántica queda claro no se puede saber donde se encuentra un electrón en un átomo ;si define la región en la que puede encontrarse en un momento dado.
5.las regiones de alto densidad electrónica representan la mayor probabilidad de localizar un electrón mientras que lo contrario se aplica a regiones de baja densidad electrónica.
6.la solución matemática de la ecuación de Schrödinger precisa de 4 números cuánticos cada cuarteto de estos valores describen una órbita y la posición de alta probabilidad del electrón.
7.el trabajo de bronglie llamo la atención de einsten quien lo considero muy importante y lo difundió entre los físicos inspirado en las ideas allí expuestas Schrödinger desarrollo entre 1925 y 1926 su teoría de la mecánica ondulatoria que es una de las maneras que se presenta la mecánica cuántica.












